Wilate 500 IU VWF / 500 IU FVIII, pulver och vätska till injektionsvätska, lösning
Wilate 1000 IU VWF / 1000 IU FVIII, pulver och vätska till injektionsvätska, lösning
Human von Willebrand-faktor / human koagulationsfaktor VIII
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Wilate är och vad det används för
- Vad du behöver veta innan du använder Wilate
- Hur du använder Wilate
- Eventuella biverkningar
- Hur Wilate ska förvaras
- Förpackningens innehåll och övriga upplysningar
1. Vad produkten är och vad den används för
Wilate tillhör den farmakoterapeutiska gruppen läkemedel som kallas koagulationsfaktorer och innehåller human von Willebrand-faktor (VWF) och koagulationsfaktor VIII. Dessa båda proteiner är tillsammans involverade i blodets koagulering.
von Willebrands sjukdom
Wilate används för att behandla och förebygga blödning hos patienter med von Willebrands sjukdom (VWD), som är en familj av besläktade sjukdomar. VWD (von Willebrands sjukdom) är en störning av blodkoaguleringen, som medför att blödning kan pågå under längre tid än förväntat. Det beror antingen på brist på von VWF eller på att VWF inte fungerar som den ska.
Hemofili A
Wilate används för att behandla och förebygga blödning hos patienter med hemofili A. Detta är en sjukdom som innebär att man blöder under längre tid än normalt. Det beror på en medfödd brist på faktor VIII i blodet.
2. Vad du behöver veta innan produkten används
Använd inte Wilate
- Om du är allergisk mot human von Willebrand-faktor, koagulationsfaktor VIII eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Wilate.
- Alla läkemedel av samma slag som Wilate som framställs från humant blod (som innehåller proteiner) och som injiceras i ett kärl (intravenös administrering) kan ge upphov till allergiska reaktioner. Var uppmärksam på tidiga tecken på allergiska reaktioner (överkänslighetsreaktioner), såsom:
- nässelutslag
- hudutslag
- tryck över bröstet
- väsande andning
- lågt blodtryck
- anafylaxi (när något eller samtliga ovanstående symtom uppträder snabbt och är intensiva)
Om sådana symtom uppträder, avbryt tillförseln omedelbart och kontakta din läkare.
- När läkemedel framställs av human plasma eller blod, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar noggrant urval av blod- och plasmagivare för att försäkra sig om att personer med risk för att vara smittbärare uteslutes, test av enskilda donationer och plasmapooler med avseende på tecken på virus/infektion och dessutom steg vid processningen av blod eller plasma som kan inaktivera eller avskilja virus. Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel som tillverkats av humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra typer av infektioner.
- De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus, såsom HIV, hepatit B och hepatit C virus och för icke höljeförsedda viruset hepatit A virus. Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus såsom parvovirus B19.
- Infektion av parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster), individer med försämrat immunförsvar eller patienter med viss typ av anemi (t.ex. sickle-cellsjukdom eller hemolytisk anemi).
När du ges Wilate rekommenderas att produktnamn och satsnummer registreras för att möjliggöra spårandet av använd produkt.
Din läkare kan komma att föreslå vaccination mot hepatit A och B om du regelbundet/upprepat behandlas med plasmaderiverade VWF/faktor VIII -koncentrat.
von Willebrands sjukdom (VWD)
- Se punkt 4 (von Willebrands sjukdom [VWD]) för biverkningar vid behandling av VWD.
Hemofili A
Utveckling av inhibitorer (antikroppar) är en känd komplikation som kan uppträda vid behandling med alla faktor VIII-läkemedel. Inhibitorerna hindrar, särskilt vid höga halter, att behandlingen fungerar som den ska. Du eller ditt barn kommer att övervakas noggrant avseende utveckling av sådana inhibitorer. Om du eller ditt barn drabbas av en blödning som inte kan kontrolleras med Wilate ska du omedelbart tala om det för din läkare.
Se punkt 4 (Hemofili A) för biverkningar vid behandling av hemofili A.
Andra läkemedel och Wilate
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Även om det inte finns någon känd påverkan av andra läkemedel på Wilate ska du informera din läkare eller apotek om du använder eller nyligen har använt något annat läkemedel (inklusive receptfria läkemedel).
Wilate får inte blandas med något annat läkemedel under injektionen.
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Wilate innehåller natrium
Detta läkemedel innehåller upp till 58,7 mg natrium ( huvudingrediensen i koksalt/bordssalt) per flaska om 500 IU VWF och 500 IU FVIII och upp till 117,3 mg per flaska om 1000 IU VWF och 1000 IU FVIII. Detta motsvarar 2,94 % respektive 5,87 % av högsta rekommenderat dagligt intag av natrium för vuxna.
3. Hur produkten används
Wilate ska injiceras i ett blodkärl (intravenös administrering) efter att ha lösts i den bipackade vätskan. Behandling ska påbörjas under övervakning av läkare.
Dosering
Din läkare bestämmer vilken dos du ska ha och hur ofta du ska ta Wilate. Använd alltid Wilate enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Om du har tagit för stor mängd av Wilate
Inga symtom på överdosering med human VWF eller faktor VIII har rapporterats. Du ska dock inte ta mer än den föreskrivna dosen. Du kan också rådfråga Giftinformationcentralen, tel. 0800 147 111.
Om du har glömt att ta Wilate
Ta inte dubbel dos för att kompensera för glömd dos.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
4. Eventuella biverkningar
Liksom alla läkemedel kan Wilate orsaka biverkningar, men alla användare behöver inte få dem.
- Överkänslighet eller allergiska reaktioner har observerats, även om det är ovanligt. Sådana reaktioner kan inkludera:
- sveda och stickande känsla vid infusionsstället
- frossa
- hudrodnad
- huvudvärk
- nässelutslag (urtikaria)
- lågt blodtryck (hypotoni)
- trötthet (letargi)
- illamående
- rastlöshet
- hjärtklappning (takykardi)
- tryck över bröstet
- stickande känsla (myrkrypningar)
- kräkning
- väsande andning
- plötslig svullnad i olika delar av kroppen (angioödem)
Om du drabbas av något av ovanstående symtom ska du informera din läkare.
Du ska sluta ta Wilate och omedelbart kontakta din läkare om du får symtom på angioödem, t.ex.:
- Svullnad av tungan, ansiktet eller halsen (svalget)
- Svårt att svälja
- Nässelutslag och svårt att andas
- Även om det är mindre vanligt har feber också observerats.
- Buksmärta, ryggsmärta, bröstsmärta, hosta och yrsel kan också förekomma, men frekvenserna för dessa biverkningar är inte kända.
- I mycket sällsynta fall kan överkänslighet leda till en svår allergisk reaktion som benämns anafylaxi (när något eller samtliga av ovanstående symtom uppträder snabbt och är intensiva), som inkluderar chock. Om anafylaktisk chock uppträder är det av största vikt att behandling ges enligt aktuella medicinska rekommendationer.
von Willebrands sjukdom (VWD)
- När en faktor VIII-produkt som innehåller VWF används för att behandla VWD kan behandlingen leda till en för kraftig ökning av FVIII i blodet. Detta kan öka risken för störningar av blodflödet (blodpropp).
Om du är en patient med riskfaktorer som konstaterats kliniskt eller genom laboratorieprover måste du kontrolleras för tidiga tecken på blodpropp. Förebyggande behandling (profylax) mot blodpropp ska förskrivas av din läkare i enlighet med aktuella rekommendationer.
Patienter med von Willebrands sjukdom (särskilt typ 3-patienter) kan utveckla hämmare (neutraliserande antikroppar) mot VWF under behandling med VWF. I dessa mycket sällsynta fall kan hämmarna göra att Wilate inte fungerar som det ska.
Om blödningen inte upphör ska ditt blod testas för förekomst av sådana hämmare.
Hämmare kan öka risken för att drabbas av svåra allergiska reaktioner (anafylaktisk chock). Om du drabbas av en allergisk reaktion ska du testas för förekomst av hämmare.
Om hämmare upptäcks i blodet ska du kontakta läkare med erfarenhet av att behandla patienter med blödningssjukdomar. För patienter med höga nivåer av hämmare kan annan typ av behandling vara effektiv och bör då övervägas.
Hemofili A
- Bland barn som inte behandlats med faktor VIII-läkemedel tidigare är det mycket vanligt att hämmande antikroppar utvecklas (se avsnitt Vad du behöver veta innan produkten används) (förekommer hos fler än 1 av 10 patienter). För patienter som tidigare har behandlats med faktor VIII (behandling mer än 150 dagar) är dock risken mindre och komplikationen är mindre vanlig (förekommer hos färre än 1 av 100 användare). Om du eller ditt barn utvecklar antikroppar kan läkemedlen upphöra att fungera som de ska, och du eller ditt barn kan drabbas av ihållande blödningar. Om detta händer ska du omedelbart kontakta läkare.
Hämmare kan öka risken för att drabbas av svåra allergiska reaktioner (anafylaktisk chock). Om du drabbas av en allergisk reaktion ska du testas för förekomst av hämmare.
|
Ovanliga: hos färre än 1 av 100 patienter
Sällsynta: hosfärre än 1 av 1 000 patienter
Mycket sällsynta: hos färre än 1 av 10 000 patienter
|
Det finns inte tillräckligt med data för att rekommendera användning av Wilate hos tidigare obehandlade patienter.
Det finns begränsade erfarenheter av behandling av barn under sex år.
För information om säkerhet avseende smittämnen, se punkt 2 (Varningar och försiktighet).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 Fimea
5. Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvara pulvret och vätskan i kylskåp (2–8 °C).
Får inte frysas.
Förvara flaskorna i ytterkartongen. Ljuskänsligt.
Används före utgångsdatum som anges på etiketten.
Wilate kan förvaras vid rumstemperatur (max. 25 °C) i 2 månader. I sådant fall löper hållbarhetstiden ut 2 månader efter det att produkten första gången togs ut ur kylskåpet. Du ska själv anteckna det nya utgångsdatumet på ytterkartongen.
Pulvret ska inte lösas förrän omedelbart före injektion. Lösningen har visats vara stabil i 4 timmar vid rumstemperatur. För att förhindra kontaminering bör dock lösningen användas omedelbart och endast en gång.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
-
De aktiva innehållsämnena är human von Willebrand-faktor och human koagulationsfaktor VIII.
-
Övriga innehållsämnen är natriumklorid, glycin, sackaros, natriumcitrat och kalciumklorid. Vätska: vatten för injektionsvätskor med 0,1 % polysorbat 80.
Läkemedlets utseende och förpackningsstorlekar
Frystorkat pulver: vitt eller blekgult pulver.
Rekonstituerad lösning: ska vara klar eller något mjölkig.
Wilate levereras som pulver och vätska till injektionsvätska för lösning i två förpackningsstorlekar:
- Wilate 500 IU VWF och 500 IU FVIII, pulver och vätska till injektionsvätska för lösning, har ett nominellt innehåll av 500 IU human von Willebrand-faktor och 500 IU human koagulationsfaktor VIII per flaska. Produkten innehåller cirka 100 IU/ml human von Willebrand-faktor och 100 IU/ml human koagulationsfaktor VIII efter upplösning i 5 ml vatten för injektionsvätska med 0,1 % polysorbat 80 (vätska till injektionsvätska).
- Wilate 1000 IU VWF och 1000 IU FVIII, pulver och vätska till injektionsvätska för lösning, har ett nominellt innehåll av 1000 IU human von Willebrand-faktor och 1000 IU human koagulationsfaktor VIII per flaska. Produkten innehåller cirka 100 IU/ml human von Willebrand-faktor och 100 IU/ml human koagulationsfaktor VIII efter upplösning i 10 ml vatten för injektionsvätska med 0,1 % polysorbat 80 (vätska till injektionsvätska).
Förpackningens innehåll
1 flaska med frystorkat pulver
1 flaska med vätska till injektionsvätska
1 förpackning med utrustning för intravenös injektion (1 överföringsset, 1 infusionsset, 1 engångsspruta)
2 desinfektionstorkar.
Innehavare av godkännande för försäljning och tillverkare
Octapharma AB
Lars Forssells gata 23
112 75 Stockholm
Sverige
Tillverkare
Octapharma Pharmazeutika
Produktionsges.m.b.H
Oberlaaerstr. 235
A-1100 Wien
Österrike
För ytterligare information om detta läkemedel, kontakta den lokala representanten för innehavaren av godkännandet för försäljning:
Octapharma Nordic AB, Råtorpsvägen 41 C, 01640 Vanda.
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Österrike, Belgien, Bulgarien, Cypern, Tjeckien, Estland, Tyskland, Ungern, Irland, Italien, Kroatien, Lettland, Litauen, Luxemburg, Malta, Nederländerna, Poland, Portugal, Rumänien, Slovenien, Slovakien, Spanien, Stor-Britannien: Wilate 500/ Wilate 1000
Finland, Norge, Sverige: Wilate
Danmark: Wilnativ
Frankrike: Eqwilate 500/ Eqwilate 1000
Denna bipacksedel ändrades senast 8.3.2021
Direktiv för användaren
Instruktioner för hemvård
- Läs noga igenom alla anvisningar och följ dem noggrant!
- Använd inte Wilate efter utgångsdatumet som står på etiketten.
- Sterilitet måste upprätthållas under proceduren som beskrivs nedan.
- Inspektera rekonstituerat läkemedel visuellt före administrering med avseende på partikar och missfärgning.
- Lösningen skall vara klar eller svagt opaliserande (mjölkig). Använd inte lösningen om den är grumlig eller har fällning.
- Använd den rekonstituerade lösningen omedelbart för att undvika mikrobiell kontamination.
- Använd enbart det medföljande injektionspaketet. Används andra injektions/infusionsredskap så kan det öka risken och förorsaka misslyckad behandling.
Anvisningar för färdigberedning av lösningen
Anvisningar för beredning av Wilate lösning (rekonstituering):
1. Använd inte produkten direkt när den tagits ur kylskåpet. Låt vätskan för injektionsvätska och pulvret i de oöppnade flaskorna uppnå rumstemperatur.
2. Ta bort kapsylerna från både flaskorna med pulver och vätska och rengör gummipropparna med desinfektionstork som medföljer.
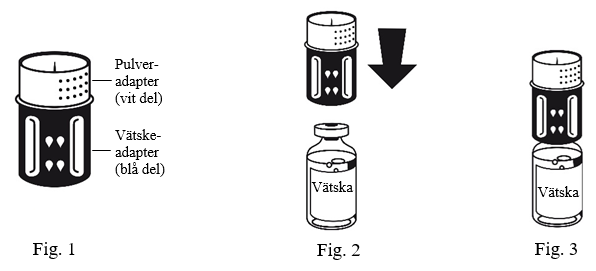
3. Överföringssetet avbildas i Fig 1. Placera injektionsflaskan med spädningsvätska på en plan yta och håll den stadigt. Ta överföringssetet och vänd den upp och ned. Sätt den blå delen av överföringssetet på flaskan med spädningsvätska och tryck bestämt tills det klickar (Fig 2+3). Vrid inte medan du ansluter.
4. Placera injektionsflaskan med pulvret på en plan yta och håll den stadigt. Ta injektionsflaskan med spädningsvätska med det anslutna överföringssetet och vänd den upp och ned. Sätt den vita delen på pulverflaskans propp och tryck bestämt tills det klickar (Fig.4). Vrid inte medan du ansluter. Vätskan rinner automatiskt över till pulverflaskan.
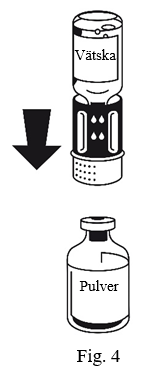
5. Rotera pulverflaskan långsamt med båda flaskorna anslutna tills pulvret löst sig.
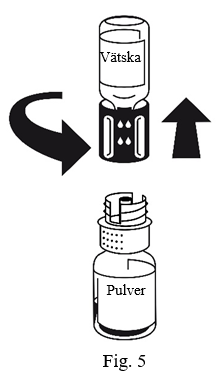
Pulvret löser sig på mindre än 10 minuter vid rumstemperatur. Lätt skumbildning kan förekomma under upplösningen. Skruva isär överföringssetet i två delar (Fig.5). Då försvinner skummet.
Kassera vätskeflaskan med den blå delen av överföringssetet fastsatt.
Anvisningar för injektion:
Som en försiktighetsåtgärd ska din puls tas före och under injektionen. Om pulsen stiger markant ska injektionshastigheten reduceras eller administrationen tillfälligt avbrytas.
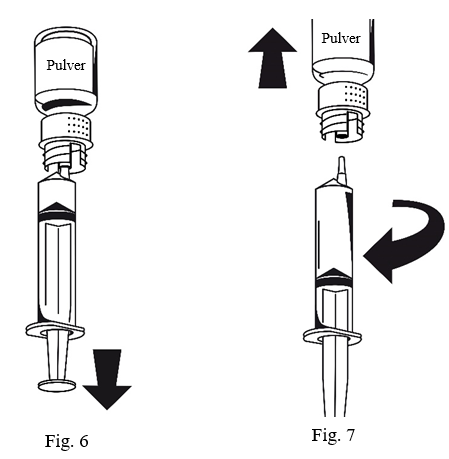
1. Anslut sprutan till den vita delen av överföringssetet. Vänd flaskan upp och ned och drag upp lösningen i sprutan (Fig.6).
Lösningen ska vara klar eller svagt opalieserande.
När lösningen har överförts, håll stadigt i sprutans kolv (med kolven nedåt) och avlägsna sprutan från överföringssetet (Fig.7).
Kassera den tomma flaskan tillsammans med den vita delen av överföringssetet.
2. Rengör det valda injektionsstället med en av de bipackade desinfektionstorkarna.
3. Anslut det bipackade infusionssetet till sprutan.
4. Stick in injektionsnålen i den valda venen. Om du har använt stasband för att lättare se venen, bör detta öppnas innan du påbörjar injektionen,
Blod får inte komma in i sprutan på grund av risken för koagelbildning
5. Injicera lösningen långsamt i venen, ej mer än 2-3 ml per minut.
Om du använder mer än en flaska Wilatepulver vid samma behandlingstillfälle kan samma injektionsset och spruta användas. Överföringssetet är endast för engångsbruk.
Oanvänd produkt eller avfallsmaterial ska förstöras i enlighet med lokala föreskrifter.
Wilate får inte blandas med andra läkemedel eller injiceras tillsammans (i samma infusionsset) med andra läkemedel.
Användas endast de infusionshjälpmedel som medföljer. Användning av andra injektions-/infusionshjälpmedel kan ge upphov till ytterligare risker och terapisvikt (adsorption av VWF/faktor VIII till de inre ytorna på vissa infusionsaggregat).