Faslodex 250 mg injektioneste, liuos
fulvestrantti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Faslodex on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Faslodexia
- Miten Faslodexia käytetään
- Mahdolliset haittavaikutukset
- Faslodexin säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Faslodexin sisältämä vaikuttava aine on fulvestrantti, joka estää estrogeenin vaikutuksia elimistössä. Estrogeeni on naishormoni, joka voi joissakin tapauksissa vaikuttaa rintasyöpäkasvaimen kasvuun.
Faslodexia käytetään joko
- yksinään estrogeenireseptoripositiivisen paikallisesti edenneen tai muualle elimistöön levinneen (etäpesäkkeisen) rintasyövän hoitoon vaihdevuodet ohittaneille naisille tai
- yhdistelmänä palbosiklibin kanssa hormonireseptoripositiivisen, HER2-negatiivisen (ihmisen epidermaalisen kasvutekijän reseptorin 2 suhteen negatiivisen) paikallisesti edenneen tai muualle elimistöön levinneen (etäpesäkkeisen) rintasyövän hoitoon naisille. Naisille, jotka eivät ole saavuttaneet vaihdevuosia, annetaan myös toista lääkettä, LHRH-agonistia (luteinisoivan hormonin vapauttajahormonin agonistia).
Kun Faslodex-valmistetta käytetään yhdistelmänä palbosiklibin kanssa on tärkeää, että luet myös palbosiklibin pakkausselosteen. Jos sinulla on kysyttävää palbosiklibista, käänny lääkärin puoleen.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Faslodexia
- jos olet allerginen fulvestrantille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa, Mitä Faslodex sisältää)
- jos olet raskaana tai imetät
- jos sinulla on vaikea maksasairaus.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Faslodexia, jos sinulla on jokin seuraavista:
- maksa- tai munuaisongelmia
- verihiutaleniukkuus (verihiutaleet edesauttavat veren hyytymistä) tai verenvuotohäiriöitä
- aiemmin esiintyneitä veritulppia
- osteoporoosi (pienentynyt luun mineraalitiheys)
- alkoholismi.
Lapset ja nuoret
Faslodexia ei ole tarkoitettu alle 18-vuotiaille lapsille ja nuorille.
Muut lääkevalmisteet ja Faslodex
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Kerro lääkärille erityisesti siitä, jos käytät verenohennuslääkkeitä (lääkkeitä, joilla estetään veritulppien muodostumista).
Raskaus ja imetys
Älä käytä Faslodexia, jos olet raskaana. Jos on mahdollista, että voit tulla raskaaksi, sinun on käytettävä tehokasta ehkäisyä Faslodex-hoidon aikana ja kahden vuoden ajan viimeisestä annoksesta.
Älä imetä Faslodex-hoidon aikana.
Ajaminen ja koneiden käyttö
Faslodex ei todennäköisesti vaikuta kykyysi ajaa autoa tai käyttää koneita. Jos kuitenkin tunnet Faslodex-hoidon jälkeen väsymystä, älä aja autoa tai käytä koneita.
Faslodex sisältää 10 % (paino/tilavuus) etanolia (alkoholia), eli enimmillään 500 mg per injektio, mikä vastaa 10 ml olutta tai 4 ml viiniä.
Haitallinen alkoholismissa.
Otettava huomioon suuren riskin ryhmissä kuten potilailla, joilla on maksasairaus tai epilepsia.
Faslodex sisältää 500 mg bentsyylialkoholia per injektio, joka vastaa 100 mg/ml.
Bentsyylialkoholi saattaa aiheuttaa allergisia reaktioita.
Faslodex sisältää 750 mg bentsyylibentsoaattia per injektio, joka vastaa 150 mg/ml.
3. Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Suositeltu annos on 500 mg fulvestranttia (kaksi 250 mg/5 ml:n injektiota) kerran kuukaudessa. Lisäksi annetaan 500 mg:n annos kahden viikon kuluttua aloitusannoksesta.
Lääkäri tai sairaanhoitaja antaa Faslodex-injektion hitaasti kumpaankin pakaralihakseen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Saatat tarvita välitöntä lääkärinhoitoa, jos sinulla ilmenee jokin seuraavista haittavaikutuksista:
- Allergiset (yliherkkyys) reaktiot mukaan lukien kasvojen, huulien, kielen ja/tai kurkun turpoaminen, jotka voivat olla anafylaktisen reaktion oireita
- Tromboembolia (suurentunut veritulppariski)*
- Maksatulehdus (hepatiitti)
- Maksan vajaatoiminta.
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos havaitset jonkin seuraavista haittavaikutuksista:
Hyvin yleiset haittavaikutukset (esiintyy useammalla kuin yhdellä 10 ihmisestä)
- Pistokohdan reaktiot, kuten kipu ja/tai tulehdus
- Maksaentsyymiarvojen epätavalliset tasot (verikokeissa)*
- Pahoinvointi
- Voimattomuus, väsymys*
- Nivelkipu ja tuki- ja liikuntaelinperäinen kipu
- Kuumat aallot
- Ihottuma
- Allergiset reaktiot (yliherkkyys), mukaan lukien kasvojen, huulien, kielen ja/tai kurkun turpoaminen.
Kaikki muut haittavaikutukset:
Yleiset haittavaikutukset (esiintyy alle yhdellä 10 ihmisestä)
- Päänsärky
- Oksentelu, ripuli tai ruokahaluttomuus*
- Virtsatieinfektiot
- Selkäkipu*
- Kohonnut bilirubiiniarvo (maksan tuottama sappiväriaine)
- Tromboembolia (suurentunut veritulppariski)*
- Vähentynyt verihiutaleiden määrä (trombosytopenia)
- Emätinverenvuoto
- Alaselkäkipu, joka säteilee toiseen jalkaan (iskias)
- Äkillinen heikkous, puutuminen, pistely tai jalan liikuntakyvyn heikkeneminen, erityisesti vain toisella puolella kehoa, äkilliset kävely- tai tasapainohäiriöt (perifeerinen neuropatia).
Melko harvinaiset haittavaikutukset (esiintyy alle yhdellä 100 ihmisestä)
- Paksu, valkeahko erite emättimestä ja kandidiaasi (tulehdus)
- Mustelmat ja verenvuoto injektiokohdassa
- Kohonnut gamma-GT-arvo (verikokeissa näkyvä maksaentsyymi)
- Maksatulehdus (hepatiitti)
- Maksan vajaatoiminta
- Tunnottomuus, pistely ja kipu
- Anafylaktiset reaktiot.
* Sisältää haittavaikutukset, joihin Faslodexin myötävaikutusta ei voida tarkalleen arvioida taustalla olevan sairauden takia.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa tai ruiskun etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä ja kuljeta jääkaapissa (2 °C‑8 °C).
Lämpötilapoikkeamia 2 °C–8 °C ulkopuolelle on rajoitettava. Valmisteen säilyttämistä yli 30 °C lämpötiloissa on vältettävä, eikä valmistetta saa säilyttää yli 28 päivää olosuhteissa, joissa keskimääräinen säilytyslämpötila on alle 25 °C (mutta yli 2 °C–8 °C). Valmiste on palautettava ohjeiden mukaisiin säilytysolosuhteisiin (säilytä ja kuljeta jääkaapissa (2 °C–8 °C)) välittömästi lämpötilapoikkeamien jälkeen. Lämpötilapoikkeamilla on kumulatiivinen vaikutus valmisteen laatuun, eikä 28 päivän säilytysajanjaksoa poikkeavissa olosuhteissa saa ylittää Faslodexin 4 vuoden kestoajan puitteissa. Altistuminen alle 2 °C lämpötiloille ei vahingoita valmistetta, jos sitä ei säilytetä alle ‑20 °C:ssa.
Säilytä esitäytetty ruisku alkuperäispakkauksessa. Herkkä valolle.
Hoitohenkilökunta vastaa Faslodexin asianmukaisesta säilytyksestä, käytöstä ja hävittämisestä.
Tämä lääkevalmiste voi aiheuttaa vaaraa vesistöille. Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Faslodex sisältää
- Vaikuttava aine on fulvestrantti. Yksi esitäytetty ruisku (5 ml) sisältää 250 mg fulvestranttia.
- Muut aineet (apuaineet) ovat etanoli (96 %), bentsyylialkoholi, bentsyylibentsoaatti ja puhdistettu risiiniöljy.
Faslodexin kuvaus ja pakkauskoko
Faslodex on kirkasta, värittömästä keltaiseen olevaa viskoosia nestettä, joka on turvasulkimella suljetussa esitäytetyssä ruiskussa. Yksi ruisku sisältää 5 ml liuosta. On annettava kaksi ruiskua, jotta saataisiin suositeltu 500 mg:n kuukausiannos.
Faslodexia on saatavana kahdessa eri pakkauskoossa, joko yhden esitäytetyn lasisen ruiskun sisältävä pakkaus tai kaksi esitäytettyä lasista ruiskua sisältävä pakkaus. Pakkauksiin kuuluu myös turvaneulat (BD SafetyGlide), jotka kiinnitetään ruiskuihin.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
AstraZeneca AB
SE-151 85 Södertälje
Ruotsi
Valmistaja
AstraZeneca AB
Global External Sourcing (GES)
Astraallén
Gärtunaporten
SE‑151 85 Södertälje
Ruotsi
AstraZeneca UK Limited
Silk Road Business Park
Macclesfield
Cheshire
SK10 2NA
Iso-Britannia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
AstraZeneca Oy
Puh/Tel: +358 10 23 010
Tämä pakkausseloste on tarkistettu viimeksi 29.8.2022
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu
Ohjeet terveydenhuollon ammattilaiselle
Faslodex 500 mg (2 x 250 mg/5 ml injektioneste) tulee antaa käyttämällä kahta esitäytettyä ruiskua (ks. kohta Miten valmistetta käytetään).
Käyttöohjeet
Varoitus – Turvaneulaa (BD SafetyGlide Shielding Hypodermic Needle) ei saa autoklavoida ennen käyttöä. Kädet tulee pitää neulan takana aina käytön ja hävityksen aikana.
Tee seuraavat toimenpiteet kummallekin ruiskulle:
- Ota lasiruisku alustalta ja tarkista, ettei ruisku ole vioittunut.
- Poista turvaneulan (BD SafetyGlide) ulompi pakkausmateriaali.
- Ennen antoa on parenteraalisista liuoksista tarkistettava silmämääräisesti, ettei liuos sisällä partikkeleita tai ole värjäytynyt.
- Pidä ruisku pystyasennossa pitämällä kiinni sen uurretusta osasta (C). Tartu toisella kädellä korkkiin (A) ja kallistele varovasti edestakaisin, kunnes korkki irtoaa ja sen voi vetää pois, älä kierrä (ks. kuva 1).
|
Kuva 1
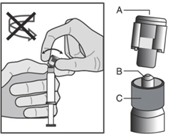
|
- Poista korkki (A) suoraan ylöspäin. Älä koske ruiskun kärkeen (B), jotta se säilyy steriilinä (ks. kuva 2).
|
Kuva 2
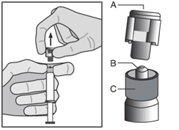
|
- Aseta turvaneula Luer-Lok ruiskuun ja kierrä kunnes se on tiukasti kiinni (ks. kuva 3).
- Tarkista, että neula on lukittunut Luer-liittimeen ennen kuin pidät neulaa muussa kuin pystyasennossa.
- Välttääksesi vahingoittamasta neulan kärkeä poista neulan suojus vetämällä se suoraan pois neulasta.
- Vie esitäytetty ruisku antopaikalle.
- Poista neulan hylsy.
- Poista ylimääräinen ilma ruiskusta.
|
Kuva 3
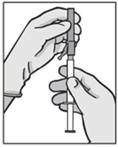
|
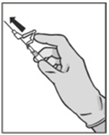
- Anna pakaralihakseen (gluteaaliselle alueelle) hitaasti (1‑2 minuuttia/injektio). Käytön helpottamiseksi neulan viistokärki ja vipuvarsi on asetettu samalle puolelle (ks. kuva 4).
|
Kuva 4
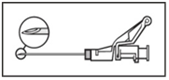
|
- Työnnä heti injektion jälkeen vipuvartta yhdellä sormen painalluksella aktivoidaksesi neulansuojausmekanismin (ks. kuva 5).
HUOM.: Aktivoi poispäin itsestäsi ja muista henkilöistä. Odota, kunnes kuulet naksahduksen, ja varmista silmämääräisesti, että neulan kärki on täysin peitossa.
|
Kuva 5
 |
Hävittäminen
Esitäytetyt ruiskut ovat vain kertakäyttöön.
Tämä lääkevalmiste voi aiheuttaa vaaraa vesistöille. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.